胶质母细胞瘤(GBM)是最常见和致死率最高的颅内肿瘤🐿,具有极强的侵袭性和免疫逃逸能力👩🏼🏭。外科切除是临床上治疗GBM的主要途径👨🦯➡️,然而,由于其浸润性生长的特征👨🏿🍼,术后复发几乎不可避免🫃。近年来,免疫治疗因其疗效好、安全性高被广泛用于多种恶性肿瘤的治疗🚶,但至今尚未在恶性GBM中取得突破。由于大脑中淋巴途径不完善🤵🏽♂️,免疫细胞数量尤其是树突状细胞(DCs)数量稀少,不容易诱发特征性免疫响应,所以中枢神经系统被认为具有“免疫特权”👳🏻。同时🪚👨🏻,GBM属于典型的冷肿瘤👫🏼,免疫原性低且进化出多种免疫逃逸机制👨🏻🚀,以对抗机体的免疫监视和毒性T淋巴细胞的攻击。上述原因导致GBM对于免疫疗法不敏感,也给通过系统给药治疗GBM复发带来了极大困难。
王建新教授团队针对GBM开展了系统性的研究,并于近日在国际控释杂志《Journal of Controlled Release》发表综述,详细介绍了复发性GBM微环境的特征及其治疗与挑战,系统回顾了基于纳米生物学技术的治疗策略,包括局部水凝胶治疗策略、新型免疫疗法和细胞疗法等🤲🏼。

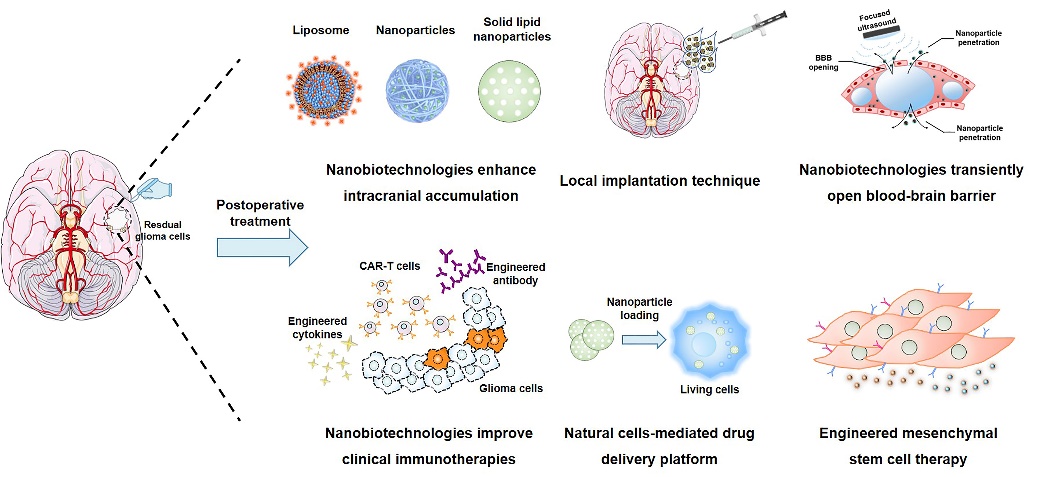
针对复发性GBM的纳米生物技术治疗策略
同时,针对复发性GBM的治疗难题,王建新教授团队研究了一种新型术后局部注射的免疫信号放大水凝胶系统🐵,通过重新激活机体抗GBM免疫响应,抑制肿瘤复发🏚。以生物可降解的海藻酸钠为凝胶骨架材料,局部注射后在生理环境下可自发形成水凝胶🙆🏼♀️,具有良好的药物缓释作用与生物安全性。凝胶系统中包载了三种治疗剂◻️,包括化疗药物多柔比星(DOX),粒细胞-巨噬细胞集落刺激因子(GM-CSF)和Toll样受体7激动剂咪喹莫特纳米粒(RAcNPs)。在手术切除GBM后🥸,将含药水凝胶注射至肿瘤切除后留下的空腔内,高浓度的海藻酸钠很快即可自发胶凝,从而有效保留在术后空腔中🙋🏻♀️,缓慢释放药物发挥治疗作用。
GBM早期复发通常发生在切除腔的附近,局部注射的化疗药物DOX能够及时杀死残余肿瘤细胞,抑制GBM早期复发,避免全身毒性🤚。同时,DOX能够有效诱导肿瘤细胞的免疫原性死亡🫅🏽,暴露肿瘤抗原。GM-CSF是一种内源性趋化因子🧏🏿♂️,能够主动招募并促进DCs成熟💽。局部释放的GM-CSF放大了免疫招募的趋化信号,代偿性提高颅内DCs的数量,为后续肿瘤抗原识别提供先决条件。咪喹莫特是一种免疫调节剂🏝,协同暴露的肿瘤抗原共同放大GBM的“危险信号”,促进DCs的成熟和激活🕷,启动下游毒性T淋巴细胞介导的抗肿瘤免疫响应。该免疫放大水凝胶系统中通过三种药物协同作用⛹🏻,联合诱发增强细胞免疫🧨,有效抑制了GBM的复发。

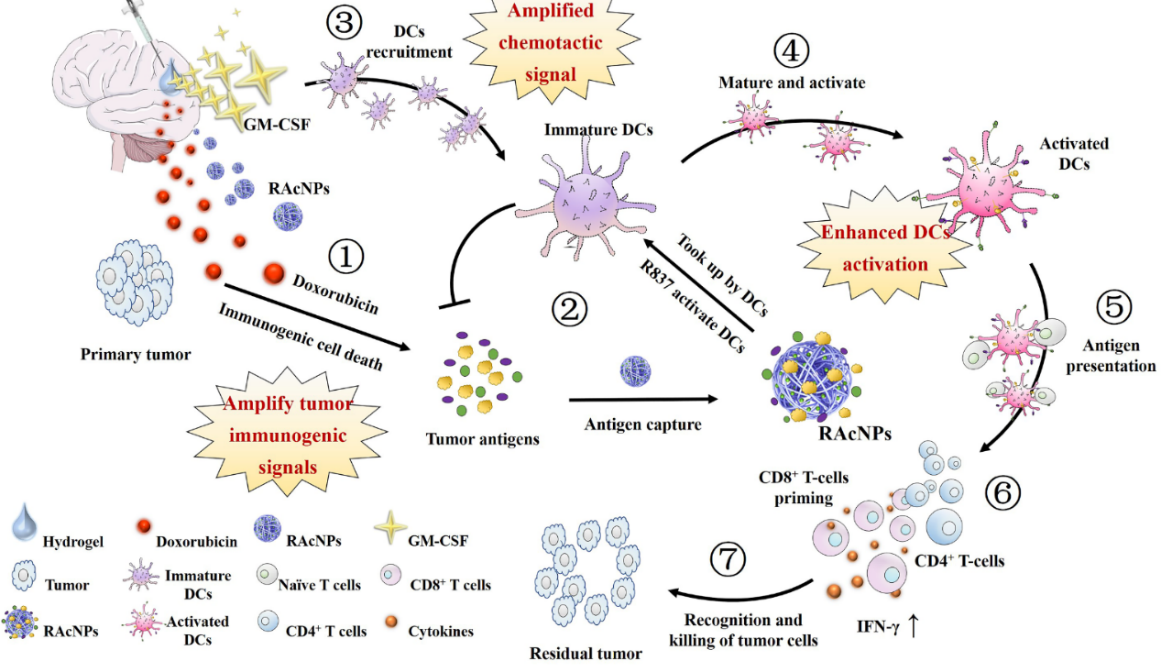
免疫放大水凝胶系统抑制GBM复发机理
基于上述实验结果,进一步将该系统开发为一种皮下注射的水凝胶疫苗,用于治疗不可切除的多发性GBM🆙。该疫苗系统沿用了海藻酸钠作为骨架材料✶,保留了GM-CSF和RAcNPs用于放大疫苗的免疫响应,并加入了GBM裂解物作为肿瘤抗原😶🌫️,避免了化疗药物的使用🕒🚘,从而消除化疗导致的毒副作用。皮下注射方式提高了临床应用的可操作性和患者的顺应性,同时可以扩大适应症范围🔳,在不可切除的小鼠多发性GBM模型上显示了显著的治疗效果🤼♂️。
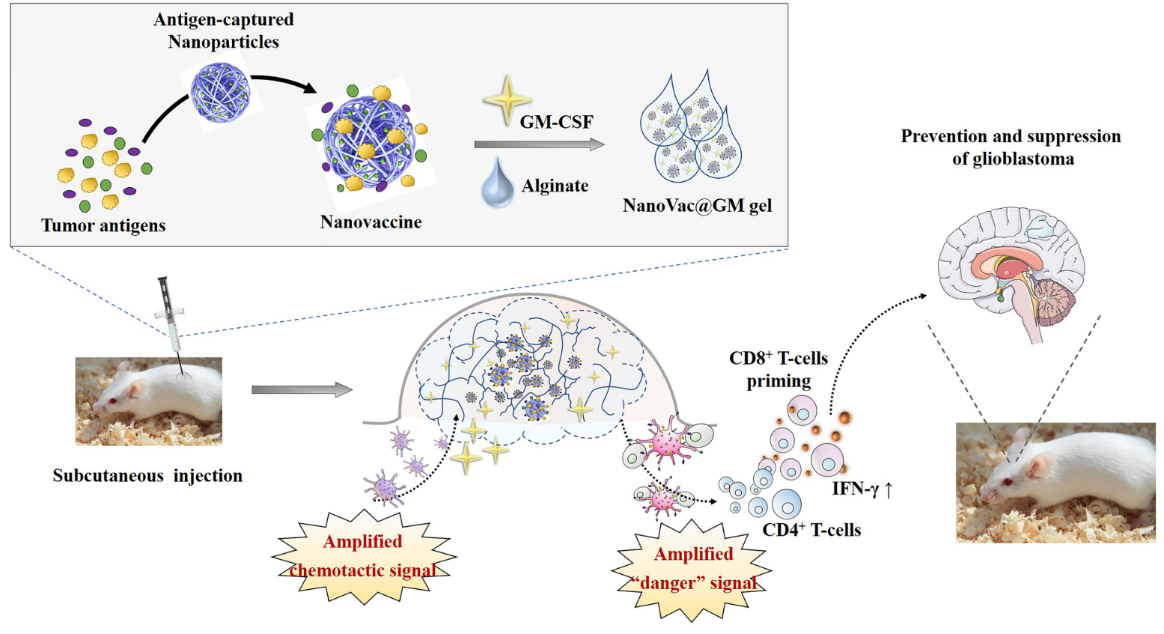
水凝胶疫苗系统治疗多发性GBM机理解释
该研究近日发表于《药学学报》英文刊(Acta Pharmaceutica Sinica B)👩🏻🦲。杏悦博士研究生邱秋钧为第一作者🧑🎓🙎🏿,王建新教授为通讯作者。
原文链接:
https://doi.org/10.1016/j.jconrel.2023.05.016
https://doi.org/10.1016/j.apsb.2023.06.010


